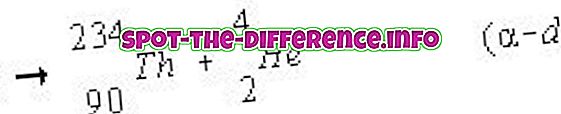Ключова різниця: атомна маса - це просто маса конкретного ізотопу, або сукупна маса протонів, нейтронів і електронів атома. Атомним числом є кількість протонів, які знаходяться в ядрі елемента.
Подивимося, що хімія заплутує, різноманітність елементів, атомні номери, зв'язки, маса, вага, атоми тощо. Всі ці слова починають розмиватися після певного часу, що людина більше не може відрізняти один від одного. Ну атомна маса і атомний номер є двома з таких слів, які часто плутаються і використовуються як взаємозамінні.
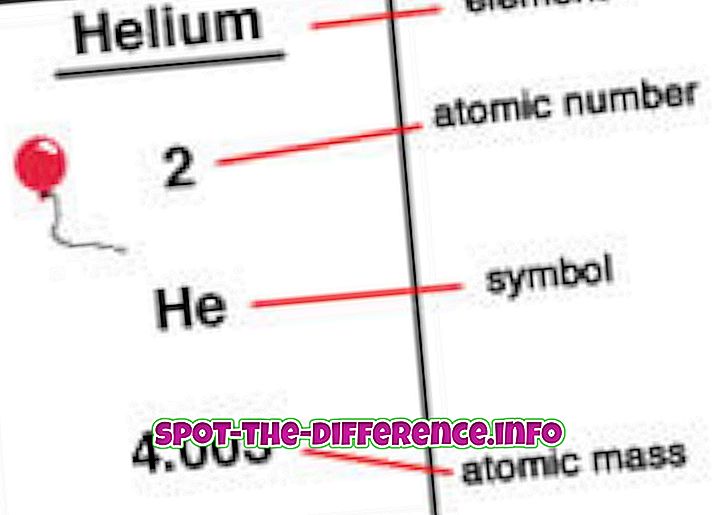
Атомна маса - це маса атома, коли вона спочиває. Це відбувається тому, що коли атом рухається з дуже високою швидкістю, він має тенденцію до збільшення маси. Хоча згідно з визначенням атомна маса є масою всіх протонів, нейтронів і електронів, електрони занадто малі, щоб зробити будь-яку істотну різницю в атомній масі. Більшість елементів на періодичній таблиці мають ізотопи і через різницю в кількості нейтронів змінюється маса кожного ізотопу.
Атомна маса виражається з використанням атомних одиниць маси або amu. Одна атомна одиниця маси дорівнює 1/12 мас маси вуглецю-12. Коли маса атома ділиться на 1/12 мас маси вуглецю-12, виходить відносна маса елемента. Проте, відносна маса об'єкта - це фактично атомна маса елемента, оскільки вона обчислюється з урахуванням всіх ізотопів. Хоча це не слід вважати атомною масою елемента.

Атомним числом є кількість протонів, які знаходяться в ядрі елемента. Коли атом нейтральний, це означає, що він має таку ж кількість протонів і електронів. Атомний номер позначається як Z. Оскільки кожен елемент має різну кількість протонів, цей номер також використовується для представлення елемента. Ізотопи, як правило, мають однаковий атомний номер, але класифікуються з використанням їх атомної маси, наприклад Carbon-12, Carbon-13.
Елементи розміщуються в порядку атомного номера на періодичній таблиці. Атоматичний номер перелічений у лівому верхньому куті елемента як верхній індекс. Атомні числа можуть допомогти розкрити інформацію про елемент, і багато людей можуть побачити атомний номер і вказати, який елемент є. Він також вказує, де в таблиці періодичної роботи він може бути розміщений і чи є він рідким, газовим або твердим. Атомне число також дає інформацію щодо заряду ядер, станів окислення, поведінки зв'язку, заряду іона тощо.